【日本】存続期間が延長登録された医薬品特許の侵害を否定した「スプリセル事件」
東京地裁令和7年5月15日判決
(令和5年(ワ)第70527号、令和6年(ワ)第70016号)
1.事件の概要
(1) 本訴
本件本訴は、別紙物件目録記載の各製剤(原告製品)を製造販売する原告が、発明の名称を「環状タンパク質チロシンキナーゼ阻害剤」とする発明に係る特許第3989175号(以下「本件特許」といい、その特許権を「本件特許権」という。)の特許権者である被告に対し、存続期間の延長登録を受けた本件特許権の効力は、原告による原告製品の生産、譲渡及び譲渡の申出に及ばない旨を主張した事案である。なお、本訴は確認の利益を欠くとして却下され、実質審理の中心は反訴に移行した。
(2) 反訴
本件反訴は、被告が、原告製品は本件特許に係る発明のうち特許請求の範囲請求項9 記載の発明(本件発明)の技術的範囲に属し、延長後の本件特許権の効力は原告による原告製品の生産等に及ぶ旨を主張して、原告に対し、本件特許権侵害の不法行為(民法 709 条。損害につき特許法 102 条 1~3 項)に基づき、1 億円の損害賠償等の支払を求めた事案である。
2.本件特許権及びその延長登録
本件特許の特許請求の範囲の請求項9は、以下のとおりである。
【請求項9】
下式
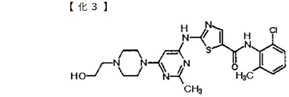
の化合物またはその塩。
被告は、本件特許権につき存続期間の延長登録出願をし、その登録を受けた。なお、延長登録は、令和6 年1 月27 日の経過をもって存続期間を満了した。
3.原告の行為
原告は、令和5 年10 月4 日、被告がダサチニブの製剤として製造販売する「スプリセル錠20mg」及び「スプリセル錠50mg」(以下、これらを併せて「スプリセル錠」という。)の後発医薬品として、原告製品について、効能・効果及び用法・用量の追加承認を取得した。
原告は、追加承認の取得に合わせて原告製品の添付文書の記載内容を変更し、同承認により追加された効能・効果、用法・用量によって特定される慢性骨髄性白血病の用途を含む原告製品の製造・販売を開始した。なお、原告製品が本件発明の技術的範囲に属する化合物を含有することは、当事者間に争いがない。
<物件目録>
1 販売名: ダサチニブ錠20mg サワイ
効能・効果:1 慢性骨髄性白血病
2 再発又は難治性のフィラデルフィア染色体陽性急性リンパ性白血病
2 販売名: ダサチニブ錠50mg サワイ
効能・効果:1 慢性骨髄性白血病
2 再発又は難治性のフィラデルフィア染色体陽性急性リンパ性白血病
(慢性骨髄性白血病)
(1) 慢性期
通常、成人にはダサチニブとして1日1回100mgを経口投与する。
なお、患者の状態により適宜増減するが、1日1回140mgまで増量できる。
(2) 移行期又は急性期
通常、成人にはダサチニブとして1回70mgを1日2回経口投与する。
なお、患者の状態により適宜増減するが、1回90mgを1日2回まで増量できる。
(再発又は難治性のフィラデルフィア染色体陽性急性リンパ性白血病)
通常、成人にはダサチニブとして1回70mgを1日2回経口投与する。
なお、患者の状態により適宜増減するが、1回90mgを1日2回まで増量できる。
4.争点
本件本訴に係る訴えは、主位的請求、予備的請求ともに、いずれも確認の利益を欠く不適法なものであるとして、いずれも却下されている。その結果、争点(反訴請求)は、以下のとおりであり、以下では、争点1について解説する。
(1) 延長登録された本件特許権の効力と原告製品(争点 1)
(2) 本件各延長登録の無効理由の有無(争点2)
ア 本件各処分によって禁止が解除された行為が本件発明の実施に該当する行為に含まれないこと(争点2-1)
イ 延長期間が過分であること(争点2-2)
(3) 被告の損害(争点 3)
5.裁判所の判断
(1)延長された特許権の効力範囲(特許法68条の2)
裁判所は、「存続期間が延長された特許権に係る特許発明の効力は、政令処分で定められた「成分、分量、用法、用量、効能及び効果」によって特定された「物」(医薬品)のみならず、これと医薬品として実質同一なものにも及ぶというべきであり、第三者はこれを予期すべきである。したがって、政令処分で定められた上記構成中に対象製品と異なる部分が存する場合であっても、当該部分が僅かな差異又は全体的にみて形式的な差異に過ぎないときは、対象製品は、医薬品として政令処分の対象となった物と実質同一なものに含まれ、存続期間が延長された特許権の効力の及ぶ範囲に属するものと解される。・・・僅かな差異又は全体的にみて形式的な差異かどうかは、特許発明の内容に基づき、その内容との関連で、政令処分において定められた「成分、分量、用法、用量、効能及び効果」によって特定された「物」と対象製品との技術的特徴及び作用効果の同一性を比較検討して、当業者の技術的常識を踏まえて判断すべきである。」と判示した。
そのうえで、裁判所は、「対象製品が政令処分で定められた「成分、分量、用法、用量、効能及び効果」によって特定された「物」と医薬品として実質同一なものに含まれる類型の一つとして、「医薬品の有効成分のみを特徴とする特許発明に関する延長登録された特許発明において、有効成分ではない「成分」に関し、対象製品が、政令処分申請時における周知・慣用技術に基づき、一部において異なる成分を付加、転換等しているような場合」を挙げることができる。この場合、その差異は上記「僅かな差異又は全体的にみて形式的な差異」に当たり、対象製品は、医薬品として政令処分の対象となった物と実質同一なものに含まれるというべきである。」と判示した。
(2)本事案の検討
裁判所は、「本件発明は、専ら医薬品の有効成分となる新規化合物を対象とした発明であり、医薬品の有効成分のみを特徴とする特許発明と理解される。前記のとおり、医薬品の有効成分のみを特徴とする特許発明に関する延長登録された特許発明において、有効成分ではない「成分」に関し、対象製品が、政令処分申請時における周知・慣用技術に基づき、一部において異なる成分を付加、転換等しているような場合、対象製品は、医薬品として政令処分の対象となった物と実質同一なものに含まれると解すべきである。」と判示した。
そのうえで、裁判所は、原告製剤は、スプリセル錠との比較において、有効成分ではない「成分」に関し、スプリセル錠が添加剤としてPEG400を添加するのに対し、原告製品ではこれを添加しておらず、コーティング剤としてカルナウバロウが添加されていることについて、「・・・」などとして、製剤の吸湿性や安定性などの観点から検討したうえで、「スプリセル錠(ダサチニブ水和物)と原告製品(ダサチニブ無水物)との有効成分の違い等に起因する課題を踏まえ、上記添加剤の付加ないし転換を行っているものとみられる。このような添加剤の付加ないし転換が周知・慣用技術に基づくものと認めるに足りる的確な証拠はなく、むしろ、原告が自己の技術等に基づき、原告製品の溶出挙動をスプリセル錠のそれに近付け、又はスプリセル錠との生物学的同等性を得るために、これらの添加剤の付加ないし転換を行ったことがうかがわれる。したがって、原告製品は、医薬品としてスプリセル錠と実質同一なものに含まれるということはできない。」と判示した。
6.コメント
本判決では、存続期間が延長登録された特許権の効力(特許法68条の2)の基本的な考え方として、政令処分で定められた「成分、分量、用法、用量、効能及び効果」によって特定された「物」(医薬品)のみならず、これと医薬品として実質同一なものにも及ぶことが判示されており、このような考え方は、「オキサリプラチン事件」(知財高裁(大合議)平成29年1月20日判決)においても判示されている。
また、本判決では、実質同一の判断手法について、「僅かな差異又は全体的にみて形式的な差異かどうかは、特許発明の内容に基づき、その内容との関連で、政令処分において定められた「成分、分量、用法、用量、効能及び効果」によって特定された「物」と対象製品との技術的特徴及び作用効果の同一性を比較検討して、当業者の技術的常識を踏まえて判断すべきである。」と判示されており、このような考え方についても、「オキサリプラチン事件」において判示されている。
さらに、本判決では、実質同一なものに含まれる類型の一つとして、「医薬品の有効成分のみを特徴とする特許発明に関する延長登録された特許発明において、有効成分ではない「成分」に関し、対象製品が、政令処分申請時における周知・慣用技術に基づき、一部において異なる成分を付加、転換等しているような場合」が示されており、このような類型は「オキサリプラチン事件」においても判示されている。
しかしながら、本判決の結論としては、「添加剤」の限度で成分を異にする事例について、「実質同一」ではないとして、延長後の特許権の効力が及ばないことが判示された。この点については、「対象製品との技術的特徴及び作用効果の同一性を比較検討して、当業者の技術的常識を踏まえて判断すべきである」という観点から、十分な比較検討が求められているところ、本判決においては、このような観点からの十分な比較検討の前に、「添加剤の付加ないし転換が周知・慣用技術に基づくものと認めるに足りる的確な証拠はない」として結論に至っている。このため、一例として示された類型への形式的な当てはめだけで判断を終えているという批判がある。(例えば、「スプリセル後発品訴訟で特許権延長制度の根幹を揺るがす形式判断」(医薬系“特許的”判例ブログ)等)
この点について、知財高裁令和7年5月27日判決(令和3年(ネ)第10037号)「ナルフラフィン事件」では、存続期間が延長登録された特許権の侵害訴訟において、「添加剤」の限度で成分を異にする事例について、「実質同一」であるとして、延長後の特許権の効力が及ぶことが認められた。その際に、添加剤の違いについて「実質同一」であると解釈されるためには、その添加剤について、その製剤の投与量において薬理作用を示さず、有効成分の治療効果を妨げないものとして加えられるものであることなどについて比較検討が行われている。
今後とも、延長登録の判断について予見可能性を高めるには、さらなる判例の蓄積が必要であり、今後の判例の動向に注目したい。
(加藤 浩)