【日本】医薬用途に関する技術常識の考え方について判示した知財高裁判決
知財高裁 令和3年12月27日判決(令和2年(行ケ)第10080号、令和2年(行ケ)第10081号)
1.事件の概要
原告(第1事件)は,発明の名称を「5-HT1A受容体サブタイプ作動薬」とする発明について,平成20年8月29日,特許権の設定登録(特許第4178032号。請求項の数6。以下「本件特許」という。)を受けた。また、原告は,平成30年8月21日,本件特許の請求項3及び6を削除する訂正審判請求(訂正2018-390120号)をしたところ、特許庁は,同年11月14日,上記訂正を認める審決をした。
被告(第1事件)は,平成30年11月12日,本件特許について特許無効審判(無効2018-800130号)を請求したところ、原告は,本件特許の請求項2を訂正する訂正請求(以下「本件訂正」という。)をした。
特許庁は,令和2年5月12日,本件訂正を認めたうえで,「請求項1,4,5に係る発明についての特許を無効とする。請求項2に係る発明についての審判請求は,成り立たない。」との審決(以下「本件審決」という。)をした。
そこで、第1事件の原告が、本件審決のうち、請求項1、4、5に係る部分の取消しを求め(第1事件)、第1事件の被告が、請求項2に係る部分の取消しを求め(第2事件)、知財高裁に提起した。
2.本件特許発明
本件訂正後の特許請求の範囲の請求項1,2,4及び5の記載は,次のとおりである(下線部は,本件訂正による訂正箇所である。以下,請求項の番号に応じて,請求項1に係る発明を「本件発明1」などという。)。
【請求項1】
鬱病,最近のエピソードが軽い躁,躁,混合状態,鬱,又は特定できない症状の発現を有する双極性I型障害,エピソードが軽い躁症状の発現を伴った再発大鬱症状の発現及び循環型を有する双極性II型障害からなる群から選ばれた5-HT1A受容体サブタイプに関連した中枢神経系の障害を治療するための医薬組成物であって,式(1):
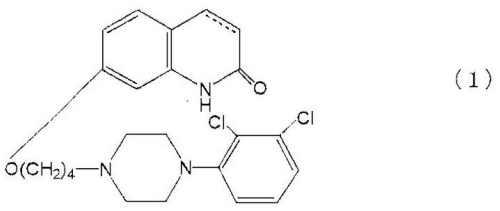
(カルボスチリル骨格の3位及び4位の間の炭素-炭素結合は,単結合又は二重結合である);
のカルボスチリル化合物,及び医薬として許容されるその塩又は溶媒和物の治療有効量を含む医薬組成物。
【請求項2】
5-HT1A部分作動薬受容体サブタイプに関連した中枢神経系の障害である鬱病を治療するための医薬組成物であって,式(1):
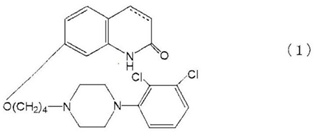
(カルボスチリル骨格の3位及び4位の間の炭素-炭素結合は,単結合又は二重結合である);
のカルボスチリル化合物,及び医薬として許容されるその塩又は溶媒和物の治療有効量を含む医薬組成物。
【請求項4】
障害が,最近のエピソードが軽い躁,躁,混合状態,鬱,又は特定できない症状の発現を有する双極性I型障害である,請求項1記載の医薬組成物。
【請求項5】
障害が,エピソードが軽い躁症状の発現を伴った再発大鬱症状の発現及び循環型を有する双極性II型障害である,請求項1記載の医薬組成物。
3.審決
本件明細書以外の他の刊行物の記載から,「鬱病の治療に5-HT1A部分作動薬を使用することができること」は技術常識であるといえるので,技術常識を参酌して、明細書に記載の薬理学的試験(in vitro 試験)の結果を見れば、請求項1に記載の鬱病に罹患した患者に投与して,本件カルボスチリル化合物が有する5-HT1A部分作動作用に基づいて当該鬱病を治療できることを,当業者は理解できる。
しかし,「5-HT1A部分作動薬を双極性障害の治療に使用することができること」が技術常識であるとはいえないから,技術常識を参酌して明細書に記載の薬理学的試験(in vitro 試験)の結果を見ても,本件カルボスチリル化合物を,請求項1に記載の双極性I型障害及び双極性II型障害のいずれかに罹患した患者に投与して,これらの対象疾患を治療できることを,当業者が理解できるとはいえない。
したがって,本件明細書の発明の詳細な説明は,本件発明1を使用することができる程度に明確かつ十分に記載されたものであるとはいえない。また,これと同様の理由により,本件明細書の発明の詳細な説明は,本件発明4及び5を使用することができる程度に明確かつ十分に記載されたものであるとはいえない。(実施可能要件違反)
また、本件発明1は,本件明細書の発明の詳細な説明に記載したものであるとはいえない。また,これと同様の理由により,本件発明4及び5は,本件明細書の発明の詳細な説明に記載したものであるとはいえない。(サポート要件違反)
4.知財高裁の判断
4-1.技術常識に関する判断
(1)抗うつ作用に関する技術常識
認定事実によれば,本件出願当時,5-HT1A受容体部分作動薬が,脳内のシナプス後5-HT1A受容体に結合することによって作動する受容体部分作動作用に基づいて,抗うつ作用を有することは技術常識であったことが認められる。そうすると,本件出願当時,5-HT1A受容体部分作動薬一般が5-HT1A受容体部分作動作用に基づく抗うつ作用によりうつ病に対して治療効果を有することは技術常識であったことが認められる。
(2)双極性障害のうつ病エピソードに対する治療効果に関する技術常識
認定事実と5-HT1A受容体部分作動薬が,脳内のシナプス後5-HT1A受容体に結合することによって発現する5-HT1A受容体部分作動作用に基づいて抗うつ作用を有することは,本件出願当時の技術常識であったことによれば,本件出願当時,5-HT1A受容体部分作動薬一般がその抗うつ作用により双極性障害のうつ病エピソードに対して治療効果を有することは技術常識であったことが認められる。
4-2.医薬用途に関する技術常識
(1)審決の判断
本件審決は,本件出願時において,各種の抗うつ薬を双極性障害の「うつ病エピソード」の治療に使用することができることは,技術常識であるが,一方で,双極性障害の患者に抗うつ薬を使用した場合,躁病エピソードの誘発,軽躁エピソードの誘発,急速交代化の誘発,及び混合状態の悪化等の様々な有害事象が生じる危険性があることを考慮すると,全ての抗うつ薬が双極性障害の「うつ病エピソード」の治療に使用することができるという技術常識があるとは言い難く,5-HT1A部分作動薬を双極性障害の「うつ病エピソード」の治療に使用できることが技術常識であるとはいえないなどとして,5-HT1A部分作動薬を双極性障害の治療に使用することができることは,本件出願時の技術常識であるとはいえない旨判断した。
(2)知財高裁の判断
医薬品の開発は,基礎研究として対象疾患の治療の標的分子(受容体等)を探索し,標的分子(受容体等)に対する薬理作用及び当該薬理作用を有する化合物を探索する薬理試験(in vitro 試験,動物実験)が実施され,このような薬理試験の結果として,化合物が有する薬理作用が疾患に対する治療効果を有すること(「医薬の有効性」)について合理的な期待が得られた段階で医薬用途発明の特許出願がされるのが一般的であるものと認められる。
一方で,薬機法は,医薬品の製造販売をしようとする者は,その品目ごとにその製造販売についての厚生労働大臣の承認を受けなければならない旨規定し(14条1項),その承認審査においては,・・・申請に係る化合物の薬効及び安全性(副作用,有害事象の有無及び程度等)を総合的に考慮し,「医薬の有用性」について審査している。
以上のような医薬品の開発の実情,医薬品の承認審査制度の内容,特許法の記載要件(実施可能要件,サポート要件)の審査は,先願主義の下で,発明の保護及び利用を図ることにより,発明を奨励し,もって産業の発達に寄与するとの特許法の目的を踏まえてされるべきものであることに鑑みると,物の発明である医薬用途発明について「その物の使用する行為」としての「実施」をすることができるというためには,当該医薬をその医薬用途の対象疾患に罹患した患者に対して投与した場合に,著しい副作用又は有害事象の危険が生ずるため投与を避けるべきことが明白であるなどの特段の事由がない限り,明細書の発明の詳細な説明の記載及び特許出願時の技術常識に基づいて,当該医薬が当該対象疾患に対して治療効果を有することを当業者が理解できるものであれば足りるものと解するのが相当である。
(3)本事例への適用
本件審決が述べる「双極性障害の患者に抗うつ薬を使用した場合,躁病エピソードの誘発,軽躁エピソードの誘発,急速交代化の誘発,及び混合状態の悪化等」の「様々な有害事象が生じる危険性」については,本件出願当時,抗うつ薬と気分安定薬とを併用することにより,躁転のリスクコントロールが可能であり,躁転発生時には抗うつ薬の中止又は漸減により対応可能であると考えられていたことに照らすと,上記特段の事由に当たるものと認められない。
そして,本件出願当時,5-HT1A受容体部分作動薬一般がその抗うつ作用により双極性障害のうつ病エピソードに対して治療効果を有することが技術常識であったことは,前記認定のとおりである。
以上のとおり,第1事件の原告主張の取消事由はいずれも理由があるから,本件審決のうち,本件発明1,4及び5に係る部分は取り消されるべきであり,第2事件の被告主張の取消事由はいずれも理由がないから,被告の請求は棄却すべきものである。
5.考察
(1)医薬用途に関する技術常識
本判決において、医薬用途に関する技術常識の考え方が示された。すなわち、「著しい副作用又は有害事象の危険が生ずるため投与を避けるべきことが明白であるなどの特段の事由」が無い限り、医薬用途に関する技術常識を考慮して、実施可能要件・サポート要件について検討することが重要になる。
本判決は、医薬発明のクレーム作成において、医薬用途としてどこまでクレームに記載することができるかについて検討する際に参考になる判決である。今後は、医薬用途に関する技術常識を的確に把握するとともに、「特段の事情」にも配慮して、クレームを作成することが重要である。
なお、前記「特段の事情」について、さらに明確にするためには、判例の蓄積が必要であり、今後の判例の動向に注目することが重要である。
(2)パテントリンケージ
本件審決に対応して、2020年7月、厚生労働省は、本件特許に対応した承認薬(エビリファイ®)の効能・効果のうち、本件審決により無効とされた「双極性障害における躁症状」についてのパテントリンケージを解除し、後発医薬品に「双極性障害における躁症状」の効能・効果の追加承認を与えた。その結果、後発医薬品メーカーは、「双極性障害における躁症状」の効能追加販売を開始した。
しかしながら、知財高裁による本件判決により、「双極性障害における躁症状」に対応した特許が有効となり、再びパテントリンケージの状況になった。無効審決が確定する前に、無効にされた特許発明の技術的範囲に含まれる後発医薬品を承認すると、その後、審決取消になる可能性があり、後発医薬品の安定供給に支障が生じかねない。今後の薬事審査の動向にも注目することが重要である。
6.参考情報(関連判決)
本判決と同日に判決された関連事件として,令和2年(行ケ)第10077号,同第10078号・82号,同第10079号・83号があり、いずれの判決にも、本稿で述べたような判示事項が示されている。
そのほか、令和2年(行ケ)第10078・82号においては、治療効果を有することを理解するにはヒト臨床試験が必須かどうかについても争われた。すなわち、被告は、「5-HT1A部分作動作用を有する化合物がヒトに対して「抗うつ作用」を有するかどうかは,実際に臨床試験によりヒトに投与してみなければ分からない」等の主張をした。
これに対して、知財高裁は、「本件出願当時,化学構造の異なる化合物について,5-HT1A受容体作動薬と抗うつ作用との関連性を述べる総説的論文が複数存在し,当業者は,5-HT1A受容体作動薬が一般的に抗うつ作用を有していることを十分に認識することができたものであり,実際にも,5-HT1A受容体作動薬というカテゴリーに注目して抗うつ薬の開発を進め,特許出願もしていたことが認められる。」等の理由を示して、被告の主張を否定した。
<参考文献>
1.令和2年(行ケ)第10077号
2.令和2年(行ケ)第10078号・82号
3.令和2年(行ケ)第10079号・83号
4.令和2年(行ケ)第10080号・81号(本判決)
知財高裁HP:令和2年(行ケ)第10080号判決文