【米国】 米国における診断方法の特許適格性
2016年5月4日、101条の審査ガイダンスのアップデート「May 2016 Subject Matter Eligibility Update」が公開され*1、ライフサイエンスの事例集(Subject Matter Eligibility Examples: Life Sciences)に新たな事例が追加された。これにより、これまでなかった診断方法にかかる事例が追加されたことから、これらの事例(Example 29およびExample 31)を検討した。
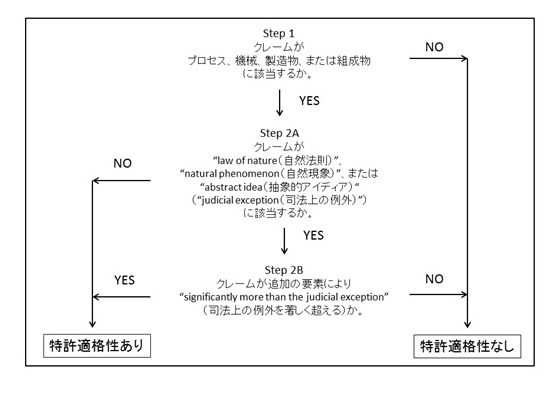
特許適格性は、2ステップテストにより判断される。Step 1は、クレームが101条に定められる4つのカテゴリー(プロセス、機械、製造物、組成物)に該当するかを判断するものである。続くStep 2Aにおいて、クレームが”judicial exception(司法上の例外)”(”law of nature(自然法則)”、”natural phenomenon(自然現象)”、”abstract idea(抽象的アイディア)”)に該当するかが判断され、Step 2AがYESの場合はStep 2Bに進み、クレームが追加の要素により”significantly more than the judicial exception”であるか(司法上の例外を著しく超えるものであるか)が判断される。Step 2AがNO、またはStep 2BがYESの場合に、特許適格性ありと判断されることになる。
Example 29は患者体内のタンパク質と疾患の相関、Example 31は遺伝子変異と疾患の相関に関するものである(各Exampleの参考訳を以下に示す)。
Exmaple 29において、生体内のタンパク質(ここでは「JUL-1」)の存在に基づき疾患を診断する工程は”judicial exception”(”law of nature” および/または “abstract idea”)である(Step 2A: YES)と判断されている(クレーム2)。かかる工程を含む方法は、追加の要素によりクレーム全体として”significantly more than the judicial exception”であるかが検討され、JUL-1の検出に特定の抗体を用いる方法(クレーム3, 4)、診断工程に加えて特定の薬剤による治療工程を含む方法(クレーム5, 6)が特許適格性あり(Step 2B: YES)と判断されている。クレーム3, 4, 5では、追加の要素が(公知ではあるが)”well-understood, routine, or conventional techniques in the filed”でないこと、クレーム6では、各要素を組合せた結果クレーム全体として” significantly more than the judicial exception”であることにより、特許適格性が認められている。
Example 31において、被験者の配列と野生型の配列の比較工程は”judicial exception”(”abstract idea”)である(Step 2A: YES)と判断され(クレーム1)、追加の要素(ここでは、ハイブリダイゼーション工程、検出工程、増幅工程、配列決定工程)によりクレーム全体として” significantly more than the judicial exception”であるかが検討されている。Example 31では、比較工程に加えて特定の技術によるハイブリダイゼーションの検出または核酸の増幅工程を含む方法が特許適格性あり(Step 2B: YES)と判断されている(クレーム70, 80)。これらの技術は、”well-understood, routine, or conventional techniques in the filed”でないとの前提である。
以上のように、生体内の物質と疾患との相関は”law of nature”であり、基準または対照との比較は”abstract idea”であると判断される。疾患との相関が新たな知見であっても、その知見の応用のための技術に特徴がなければ、特許適格性が認めらない。出願時には実施予定の技術が定まっていないことが多いと考えられるものの、一般的な記載に留めず、できるだけ具体的な検出方法、検出試薬などを検討し、明細書に記載しておくことが必要である。研究開発時に、実施時の使用技術も考慮した検討を行うことが望ましい。
Example 29のクレーム1において、抗体によるJUL-1の検出は特許適格性を有すると判断されており、Example 31では、前記の特定の技術によるハイブリダイゼーションの検出方法および核酸の増幅方法は特許適格性を有すると判断されている(クレーム75, 85)。これらの事例は、そもそも”judicial exception”に該当しない(Step 2A: NO)と判断されており、”judicial exception”に該当する(Step 2A: YES)ものの追加の要素(検出用の抗体や検出方法、核酸増幅方法)により” significantly more than the judicial exception”である(Step 2B: YES)、と判断されているのではない。しかしながら、Ariosa Diagnostics, Inc. v Sequenom, Inc.では、妊婦の血液から胎児由来の父系遺伝核酸を検出する方法は特許適格性を有さない(”judicial exception”に該当する)と判断されている*2。また、Genetic Tech. Ltd. v Merial LLC (Fed Cir. April 8, 2016) では、2ステップテストにより、遺伝子の検出方法が”judicial exception”に該当するとの判断がなされている*3。診断や比較に言及しない検出方法についても、具体的な検出方法、検出試薬等の限定が可能なように記載しておく必要がある。
*1 当所IPニュース https://www.aoyamapat.gr.jp/news/882
*2 当所IPニュース https://www.aoyamapat.gr.jp/news/842
2016年6月27日にSequenomの最高裁上告は不受理とされた。
*3 http://www.cafc.uscourts.gov/sites/default/files/opinions-orders/15-1202.Opinion.4-6-2016.1.PDF
(各Exapmpleの参考訳)
Example 29
|
請求項 |
特許適格性 |
Step 2A: “judicial exception” に該当するか |
Step 2B: “significantly more than the judicial exception” であるか |
|
1 |
あり |
NO |
– |
|
2 |
なし |
YES |
NO |
|
3 |
あり |
YES |
YES |
|
4 |
あり |
YES |
YES |
|
5 |
あり |
YES |
YES |
|
6 |
あり |
YES |
YES |
|
7 |
あり |
NO |
– |
|
1 |
A method of detecting JUL-1 in a patient, said method comprising: a. obtaining a plasma sample from a human patient; and b. detecting whether JUL-1 is present in the plasma sample by contacting the plasma sample with an anti-JUL-1 antibody and detecting binding between JUL-1 and the antibody.
患者においてJUL-1を検出する方法であって、 a.ヒト患者から血漿試料を得ること;および b.前記血漿試料を抗JUL-1抗体と接触させ、JUL-1と前記抗体との結合を検出することにより、前記血漿試料中にJUL-1が存在するかを検出すること を含む方法。
|
|
2. |
A method of diagnosing julitis in a patient, said method comprising: a. obtaining a plasma sample from a human patient; b. detecting whether JUL-1 is present in the plasma sample by contacting the plasma sample with an anti-JUL-1 antibody and detecting binding between JUL-1 and the antibody; and c. diagnosing the patient with julitis when the presence of JUL-1 in the plasma sample is detected.
患者においてjulitisを診断する方法であって、 a.ヒト患者から血漿試料を得ること; b.前記血漿試料を抗JUL-1抗体と接触させ、JUL-1と前記抗体との結合を検出することにより、JUL-1が血漿試料中に存在するかを検出すること;および c.前記血漿試料中にJUL-1の存在が検出された場合に、前記患者がjulitisを発病していると診断すること を含む方法。
|
|
3 |
A method of diagnosing julitis in a patient, said method comprising: a. obtaining a plasma sample from a human patient; b. detecting whether JUL-1 is present in the plasma sample by contacting the plasma sample with a porcine anti-JUL-1 antibody and detecting binding between JUL-1 and the porcine antibody; and c. diagnosing the patient with julitis when the presence of JUL-1 in the plasma sample is detected.
患者においてjulitisを診断する方法であって、 a.ヒト患者から血漿試料を得ること; b.前記血漿試料をブタ抗JUL-1抗体と接触させ、JUL-1と前記ブタ抗JUL-1抗体との結合を検出することにより、前記血漿試料中にJUL-1が存在するかを検出すること;および c.前記血漿試料中にJUL-1の存在が検出された場合に、前記患者がjulitisを発病していると診断すること を含む方法。
|
|
4 |
A method of diagnosing julitis in a patient, said method comprising: a. obtaining a plasma sample from a human patient; b. detecting whether JUL-1 is present in the plasma sample by contacting the plasma sample with antibody mAb-D33 and detecting binding between JUL-1 and antibody mAb-D33; and c. diagnosing the patient with julitis when the presence of JUL-1 in the plasma sample is detected.
患者においてjulitisを診断する方法であって、 a.ヒト患者から血漿試料を得ること; b.前記血漿試料をmAb-D33抗体と接触させ、JUL-1とmAb-D33抗体との結合を検出することにより、前記血漿試料中にJUL-1が存在するかを検出すること;および c.前記血漿試料中にJUL-1の存在が検出された場合に、前記患者がjulitisを発病していると診断すること を含む方法。
|
|
5 |
A method of diagnosing and treating julitis in a patient, said method comprising: a. obtaining a plasma sample from a human patient; b. detecting whether JUL-1 is present in the plasma sample; c. diagnosing the patient with julitis when the presence of JUL-1 in the plasma sample is detected; and d. administering an effective amount of topical vitamin D to the diagnosed patient.
患者においてjulitisを診断および治療する方法であって、 a.ヒト患者から血漿試料を得ること; b.前記血漿試料中にJUL-1が存在するかを検出すること; c.前記血漿試料中にJUL-1の存在が検出された場合に、前記患者がjulitisを発病していると診断すること;および d.診断をうけた患者に有効量のビタミンDを局所投与すること を含む方法。
|
|
6 |
A method of diagnosing and treating julitis in a patient, said method comprising: a. obtaining a plasma sample from a human patient; b. detecting whether JUL-1 is present in the plasma sample; c. diagnosing the patient with julitis when the presence of JUL-1 in the plasma sample is detected; and d. administering an effective amount of anti-tumor necrosis factor (TNF) antibodies to the diagnosed patient.
患者においてjulitisを診断および治療する方法であって、 a.ヒト患者から血漿試料を得ること; b.前記血漿試料中にJUL-1が存在するかを検出すること; c.前記血漿試料中にJUL-1の存在が検出された場合に、前記患者がjulitisを発病していると診断すること;および d.診断をうけた患者に有効量の抗TNF抗体を投与すること を含む方法。
|
|
7 |
A method of treating a patient with julitis, the method comprising administering an effective amount of anti-TNF antibodies to a patient suffering from julitis.
Julitisを発病している患者を治療する方法であって、julitisを患う患者に有効量の抗TNF抗体を投与することを含む方法。
|
Example 31
|
Claim |
特許適格性 |
Step 2A: “judicial exception” に該当するか |
Step 2B: “significantly more than the judicial exception” であるか |
|
1 |
なし |
YES |
NO |
|
70 |
あり |
YES |
YES |
|
75 |
あり |
NO |
– |
|
80 |
あり |
YES |
YES |
|
85 |
あり |
NO |
– |
|
1 |
A method for screening germline of a human subject for an alteration of a BRCA1 gene which comprises comparing germline sequence of a BRCA1 gene or BRCA1 RNA from a tissue sample from said subject or a sequence of BRCA1 cDNA made from mRNA from said sample with germline sequences of wild-type BRCA1 gene, wild-type BRCA1 RNA or wild-type BRCA1 cDNA, wherein a difference in the sequence of the BRCA1 gene, BRCA1 RNA or BRCA1 cDNA of the subject from wild-type indicates an alteration in the BRCA1 gene in said subject.
ヒト被験者の生殖系列をBRCA1遺伝子の変化についてスクリーニングする方法であって、前記被験者の組織サンプル由来のBRCA1遺伝子またはBRCA1 RNAの生殖系列配列、または前記サンプル由来のmRNAから調製されたBRCA1 cDNAの配列を、野生型BRCA1遺伝子、野生型BRCA1 RNA、または野生型BRCA1 cDNAと比較することを含み、被験者のBRCA1遺伝子、BRCA1 RNAまたはBRCA1 cDNAの配列における野生型との相違が前記被験者のBRCA1遺伝子における変化を示す、方法。
|
|
70 |
The method of claim 1, wherein said comparing BRCA1 sequences further comprises: hybridizing a wild-type probe to a BRCA1 gene isolated from said sample; and detecting the presence of a hybridization product by measuring conformational changes in the probe that are indicative of hybridization to the BRCA1 gene with scanning near-field optical microscopy.
BRCA1配列の比較が、さらに、 前記サンプルから単離されたBRCA1遺伝子に野生型プローブをハイブリダイズさせること;および BRCA1遺伝子とのハイブリダイゼーションの指標であるプローブの立体構造変化を走査型近接場光学顕微鏡を用いて測定することによって、ハイブリダイゼーション産物の存在を検出すること を含む、請求項1記載の方法。
|
|
75 |
A method for hybridizing BRCA1 sequences comprising: hybridizing a wild-type probe to a BRCA1 gene isolated from a tissue sample from a human subject; and detecting the presence of a hybridization product by measuring conformational changes in the probe that are indicative of hybridization to the BRCA1 gene with scanning near-field optical microscopy.
BRCA1配列をハイブリダイズさせる方法であって、 ヒト被験者由来の組織サンプルから単離されたBRCA1遺伝子と野生型プローブとをハイブリダイズさせること;および BRCA1遺伝子とのハイブリダイゼーションの指標であるプローブの立体構造変化を走査型近接場光学顕微鏡を用いて測定することによって、ハイブリダイゼーション産物の存在を検出すること を含む方法。
|
|
80 |
The method of claim 1, wherein said comparing BRCA1 sequences further comprises: amplifying by Cool-Melt PCR all or part of a BRCA1 gene from said sample using a set of primers to produce amplified nucleic acids; and sequencing the amplified nucleic acids.
BRCA1配列の比較が、さらに、 前記サンプル由来のBRCA1遺伝子の全部または一部を、プライマーセットを用いてCool-Melt PCRにより増幅し、増幅された核酸を生成すること;および 増幅された核酸の配列を決定すること を含む、請求項1記載の方法。
|
|
85 |
A method for amplifying BRCA1 sequences comprising: amplifying by Cool-Melt PCR all or part of a BRCA1 gene from a tissue sample from a human subject using a set of primers to produce amplified nucleic acids; and sequencing the amplified nucleic acids.
BRCA1配列を増幅する方法であって、 ヒト被験者の組織サンプル由来のBRCA1遺伝子の全部または一部を、プライマーセットを用いてCool-Melt PCRにより増幅し、増幅された核酸を生成すること;および 増幅された核酸の配列を決定すること を含む方法。
|